ستون های ایمونوافینیتی یکی از ابزارهای کار به روش ایمونواسی (Immunoassay) می باشد. اساس کار در این روش، اتصال آنتی بادی – آنتی ژن (قفل-کلید) است. در ستون ایمونوافینیتی، آنتی بادی بر روی یک بستر تثبیت شده و در یک ستون -یک یا چند میلی لیتری- پر شده و برای تخلیص و تغلیظ آنتی ژن استفاده می شود. این روش بخصوص اگر با استفاده از آنتی بادی های مونوکلونال مورد استفاده قرار گیرد، یک روش کاملا اختصاصی برای آنالیز در مقادیر کم (Trace Analysis) به شمار می رود.
مزیت بزرگ ستون های ایمونوافینیتی این است که این ستون ها به طور همزمان فرایندهای پاکسازی، استخراج و تغلیظ آنالیت از عصاره ی استخراجی را انجام می دهند که تغلیظ خود به افزایش حساسیت، کاهش حد تشخیص (LOD) و حد تعیین مقدار ( LOQ ) عملی روش آزمون، کمک شایانی میکند. در حوزه سلامت مواد غذایی، بافت نمونه (Matrix) یکی از مزاحمتهای غیر قابل انکار در آنالیز مواد غذایی و تعیین آلاینده های موجود (بخصوص در غلظتهای درحدد ppb) در آن است.
امروزه ستون های ایمونوافینیتی ( IACs ) به طور گسترده ای برای تخلیص و تغلیظ مایکوتوکسین های استخراج شده از خوراک انسان و دام، به ویژه آفلاتوکسین های گروه B&G (Aflatoxins B&G)، اکراتوکسین A (Ochratoxin A)، داکسی نیوالنول (Deoxynivalenol)، زیرالنون (Zearalenone)، فومونیزین های گروه B (Fumonisins B1&B2) ،T2-توکسین ( T-2 Toxin )، HT2-توکسین ( HT-2 Toxin ) استفاده می شوند.
کاربرد ستون ایمونوافینیتی چیست؟
ستون های ایمونوافینیتی برای آنالیز طیف گسترده ای از آنالیت ها در محدوده وسیعی از بافت های طبیعی مورد استفاده قرار می گیرند که تعدادی از آنها در ادامه آورده شده اند.
| آنالیت | بافت |
| مایکوتوکسین ها (آفلاتوکسین، اکراتوکسین، زیرالنون، داکسینیوالنون و …) | ادویه ها، بادام زمینی، پسته، روغن زیتون، چای (سبز)، شیر، ذرت و سایرغلات |
| سموم کشاورزی (سموم فنیل اوره، تری آزین و …) | بادام زمینی، میوه ها و سبزیجات، میوه های ترش، آب میوه ها، صیفی جات و غلات |
| ویتامین ها (B۱۲) | جگر، گوشت مرغ، تخم مرغ، ماهی، شیر و شیرخشک |
| داروهای دامی (تتراسایکلین، هورمون ها، کلرامفنیکول، پنیسیلین و …) | شیر، بافت ماهیچه، جگر، عسل، نمونه های بیولوژیکی (خون، ادرار و غیره) |
چگونه می توان از ستون ایمونوافینیتی در آنالیز مایکوتوکسینها استفاده کرد؟
اصول کاری ستون های ایمونوافینیتی تقریباً ساده است. ستون در ابتدا با محلول نمکی بافر فسفات (PBS) آماده (Condition) می شود و سپس عصاره نمونه حاوی آنالیت و درصد پایینی از حلال آلی به آرامی از روی ستون عبور داده می شود (Loading). پس از عبور عصاره از روی ستون، ژل توسط محلول نمکی بافر فسفات شست و شو داده شده (Washing) و در نهایت آنالیت های جذب شده بر روی ستون ایمونوافینیتی توسط یک حلال واجذبی – مانند متانول یا استونیتریل – شکسته (Elution) و محلول واجذبی به دستگاه آنالیز مانند دستگاه کروماتوگرافی مایع با کارآئی بالا (HPLC) تزریق و شناسائی و تعیین مقدار می گردد.
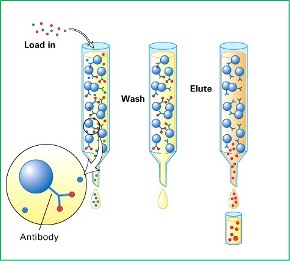
در هنگام کار با ستون های ایمونوافینیتی در آنالیز مایکوتوکسین ها به چه نکاتی باید دقت کنیم؟
- بهترین روش کار با هر کیت تجاری از جمله ستون مایکوتوکسین ها معمولا توسط سازنده آن ارائه می گردد. بنابراین اکیدا توصیه می شود در ابتدا دستورالعمل محصول مطالعه و نقاط بحرانی فرایند شناسایی شوند.
- جهت آماده سازی اولیه ستون برای ایجاد بهترین عملکرد، حتما قبل از استفاده از ستون های ایمونوافینیتی، آن ها را در دمای محیط با ۱۰ الی ۱۵ میلی لیتر محلول نمکی بافر فسفات شستشو دهید.
- معمولا مایکوتوکسین ها با استفاده از درصد بالایی از حلال آلی از نمونه استخراج می شوند، اما قبل از عبور عصاره از ستون، باید با رقیق سازی، میزان حلال آلی آن به مقداری که سازنده توصیه کرده کاهش یابد. چرا که حلال های آلی می توانند مانع از جذب آنالیت بر روی ستون شود. یا به عبارت دیگر اتصال آنتی بادی – آنتی ژن را تخریب نماید.
- چربی باعث کاهش عملکرد ستون ایمونوافینیتی می شود، بهتر است چربی نمونه ها بخصوص دانه های روغنی و مغزهای خوراکی پیش از عبور از ستون جدا شود.
- عصاره را می توان تحت تاثیر جریان گرانشی یا ایجاد خلا و یا فشار مثبت / منفی از ستون عبور داد اما نکته مهم در این امر یکنواخت بودن سرعت جریان عبور نمونه در تمامی آزمون ها است تا نتایج کار تکرارپذير باشد.
- نوع آنتی بادی استفاده شده در ستون در میزان راندمان استخراج تاثیرگذار است و هرچه تناسب بیشتری بین آنتی بادی و آنالیت هدف بیشتر باشد راندمان استخراج بیشتر خواهد بود. آنتی بادی های مونوکلونال بهترین ویژگی (Specificity) را به روش آزمون می بخشند.
- ظرفیت ستون بر حسب تعداد کل محل های آنتی بادی موجود برای اتصال تعریف می شود و بارگذاری آنالیت در مقداری بیش از حد ظرفیت ستون، منجر به بازیابی ضعیف (ریکاوری پایین) می شود.
- تنظیم اسیدیته (pH) در کارایی استخراج (به ویژه در آنالیز اکراتوکسین ها) و همچنین سرعت تخریب ستون تاثیر بسزایی داشته و می بایست بررسی شود.
- در مورد نمونه های رنگی، قبل از مرحله elution یا شویش، نیاز است به کمک محلول توئین بستر ستون رنگبری شود.
آیا این ستون ها قابلیت بازیابی و استفاده مجدد دارند؟
علیرغم کارایی بسیار خوب ستون های ایمونوافینیتی در استخراج (بویژه برای مایکوتوکسین ها) و تجاری شدن آن، قیمت این ستون ها همواره از جمله مواردی است که مانع از توسعه بیشتر آن در استفاده روزمره و همچنین اتوماسیون روش استخراج و خالص سازی به کمک این ستون ها شده است. به همین منظور توانایی بازیابی و استفاده مجدد از این ستون ها همواره مورد بحث بوده است.
بطور کلی استفاده مجدد از ستون های ایمونوافینیتی آزمون مایکوتوکسین ها توسط هیچ یک از سازندگان بین المللی آن توصیه نشده است. اما در این باره تحقیقاتی در مجلات بین المللی به چاپ رسیده است که در آن امکان و شرایط بازیابی (Regeneration) این ستون ها مورد بررسی قرار گرفته است [۶-۲]. مطابق آنچه در این مقالات به آن اشاره شده است پارامترهای موثر بر بازیابی این ستون ها شامل نوع ماتریس، نحوه کار با ستون، نوع آنالیت، ظرفیت اولیه ی ستون، نحوه ی نگهداری پس از استفاده، زمان استفاده مجدد، و مواردی دیگر می باشد.
منابع:
[۱] Şenyuva HZ, Gilbert J. Immunoaffinity column clean-up techniques in food analysis: A review. Journal of Chromatography B. 2010 Jan 15;878(2):115-32.
[۲] Scott PM, Trucksess MW. Application of immunoaffinity columns to mycotoxin analysis. Journal of AOAC International. 1997 Sep 1;80(5):941-50.
[۳] Rhemrev R, Pazdanska M, Marley E, Biselli S, Staiger S. Automated aflatoxin analysis using inline reusable immunoaffinity column cleanup and LC-fluorescence detection. Journal of AOAC International. 2015 Nov 1;98(6):1585-90.
[۴] Iha MH, Mini CA, Okada IA, de Cássia Briganti R, Trucksess MW. The use of regenerated immunoaffinity columns for aflatoxins B1, B2, G1 and G2 in peanut confection. Journal of Chromatography A. 2017 Feb 3; 1483:1-7.
[۵] Boudra H, Morgavi DP. Development and validation of a HPLC method for the quantitation of ochratoxins in plasma and raw milk. Journal of Chromatography B. 2006 Nov 7;843(2):295-301.
[۶] Liu X, Liu X, Huang P, Wei F, Ying G, Lu J, Zhou L, Kong W. Regeneration and reuse of immunoaffinity column for highly efficient clean-up and economic detection of Ochratoxin A in malt and ginger. Toxins. 2018 Nov 8;10(11):462.